发表期刊:《nature nanotechnology》
标题:Meso–macroporous hydrogel for direct litre-scale isolation of extracellular vesicles
发表时间:2025.9
研究者:韩国科学技术院和高丽大学等联合团队
领域:外囊泡纯化、分离材料开发
研究成果简介:
细胞外囊泡(EVs)是细胞分泌的脂质双层膜结构小囊泡,大小从30到1000纳米不等,广泛存在于体液中,如血液、唾液、尿液等。它们在细胞间通讯中起着关键作用,携带了来源细胞的RNA、DNA、脂质和蛋白质等成分,因此被视为多种疾病的生物标志物载体,如癌症和神经退行性疾病。在生物医学领域,EVs的应用不断拓展,包括作为治疗载体,如间充质干细胞来源的治疗成分递送,以及穿越生物屏障(如血脑屏障)的药物递送,以增强治疗效果。
传统的分离方法,如超速离心和密度梯度超速离心,虽然被认为是EVs分离的“金标准”,但需要昂贵的设备,且过程繁琐耗时;
其他方法,如尺寸排阻色谱法,虽然无需超速离心,但无法浓缩EVs,且成本较高,通量有限;
新兴技术,如非对称流场流分离、切向流过滤、电化学流体刺激和双耦合谐振振荡(EXODUS)等,虽然具有一定的优势,但所有传统和现代的EVs分离方法都需要对样品进行预处理,如连续离心和微滤。
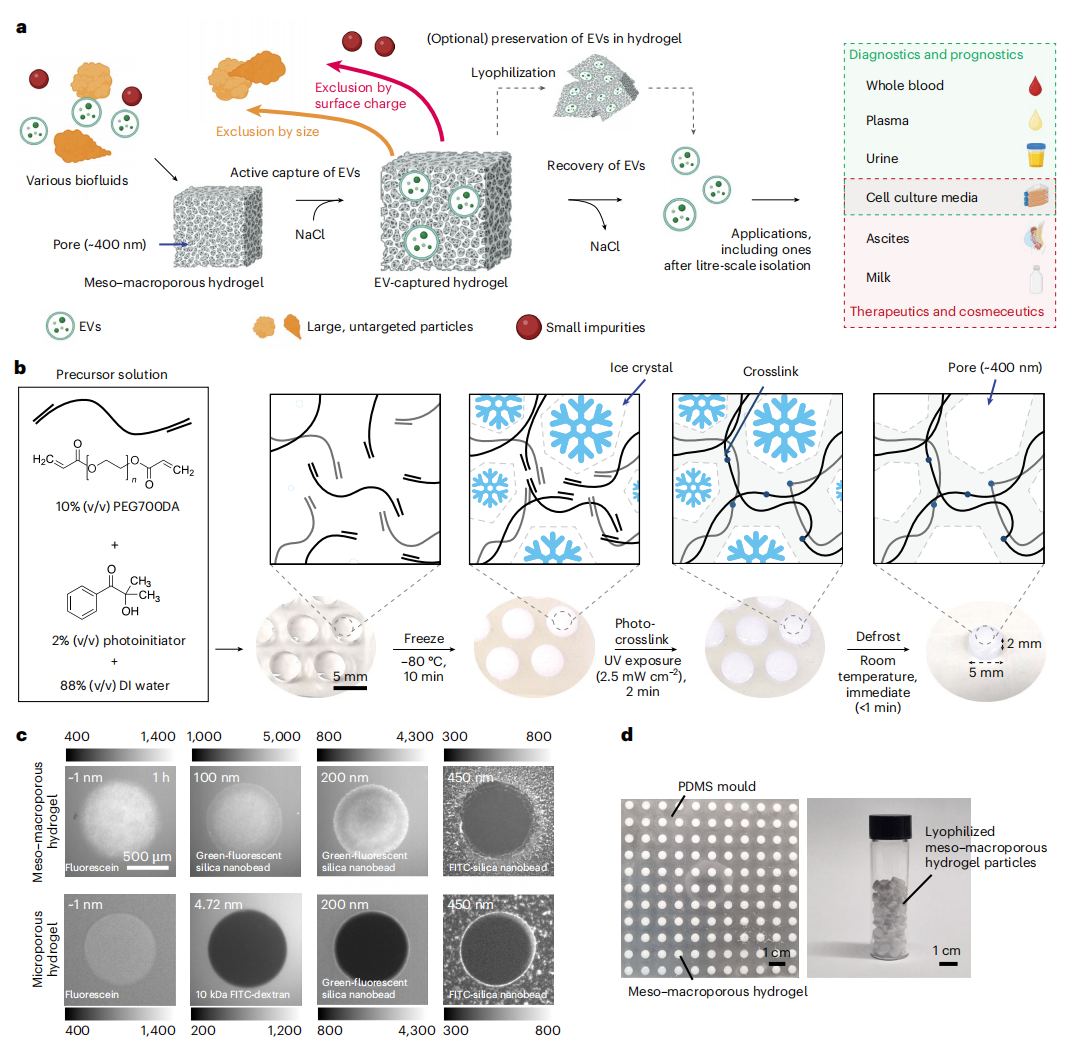
为了解决这些问题,本研究提出了一种独特的介孔 - 大孔水凝胶基质,用于简便、可扩展的EVs分离。这种水凝胶基质的孔径约为400纳米,能够实现从微升到升规模的EVs分离,无需预处理,适用于多种生物液体,包括全血、血浆、腹水、唾液、尿液、牛奶和细胞培养基等。这一技术的开发,不仅提高了EVs分离的效率和通量,还降低了分离成本,为EVs在生物医学研究和临床应用中的进一步发展提供了有力支持。
基于水凝胶的直接EV分离技术概述及介观-大孔水凝胶颗粒的制备与孔隙表征
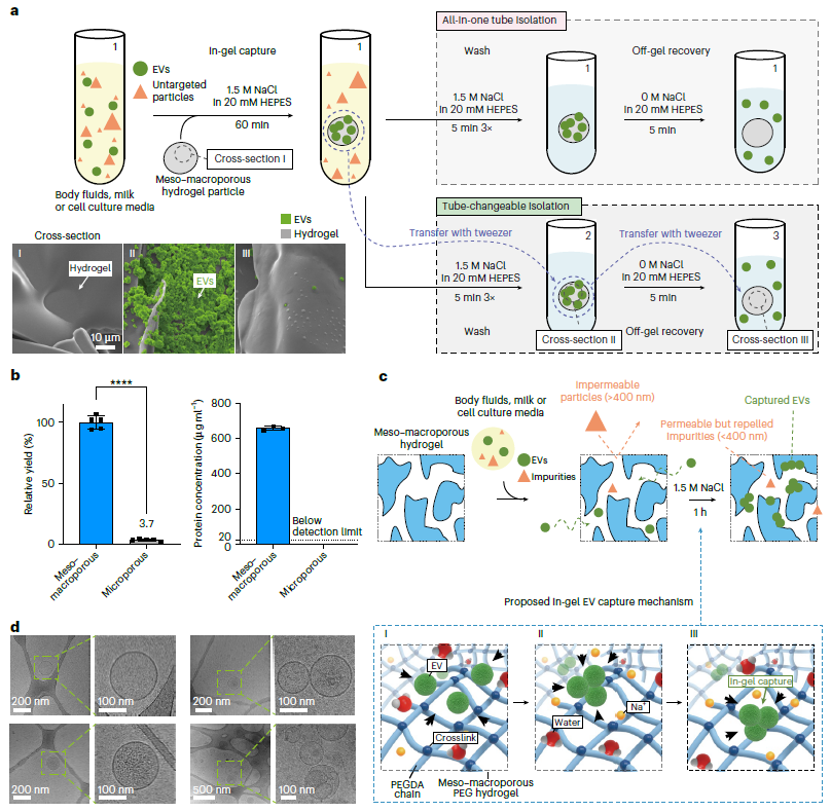
介观-大孔水凝胶直接分离EV的流程与原理